中国成人艰难梭菌感染诊断和治疗专家共识
作者丨中国医师协会检验医师分会感染性疾病检验医学专家委员会
中国成人艰难梭菌感染诊断和治疗专家共识
社区感染性腹泻,尤其是伪膜性肠炎等相关疾病的重要病原体,近年来在欧美等发达国家及地区日益受到关注。但在中国,医学领域对艰难梭菌感染( Clostridium difficile infection,CDI) 的认识尚且不足。迄今为止,我国尚未有针对CDI 诊断和治疗的指南、行业标准或专家共识出台。因此,中国医师协会检验医师分会感染性疾病检验医学专家委员会联合我国行业内各领域知名专家,共同撰写了本共识,旨在加强临床医务工作者对CDI 的认识,提高对该种疾病的精准诊断、治疗与防控能力。
艰难梭菌感染
CD 是一种革兰阳性厌氧芽孢杆菌,是引起院内肠道感染的主要致病菌之一。临床上,约15%-25% 的抗菌药物相关性腹泻( antibiotic associated diarrhea,AAD) 、50% ~ 75% 的抗菌药物相关性结肠炎和95% ~ 100% 的伪膜性肠炎( pseudomembranouscolitis,PMC) 是由CDI 引起[1]。CDI 主要是由产毒素CD 过度繁殖导致肠道菌群失调并释放毒素所引起,主要临床症状为发热、腹痛、水样便腹泻。CDI 通常由长期或不规范使用抗菌药物引起,轻者引起腹泻,严重者引发伪膜性肠炎,且常伴有中毒性巨结肠、肠穿孔、感染性休克等并发症,甚至最终导致死亡。
艰难梭菌毒力因子及致病机制
CD 的主要毒力因子为肠毒素A ( 308 kD) 和细胞毒素B ( 270 kD) ,两者均由N-端葡萄糖基转移酶催化区( glucosyltransferase domain,GTD) 、半胱氨酸蛋白酶活性区( cysteine proteinase domain,CPD) 、跨膜区( transmembrane domain,TMD) 和C-端受体结合区( receptor binding domain,RBD) 组成[2]。其毒素作用的分子机理为:( 1) 毒素受体结合区( C 端重复序列)与细胞受体特异结合; ( 2) 毒素-受体形成复合物并引发细胞内吞噬作用; ( 3) 酸性环境使毒素构象发生变化,使毒素的跨膜区插入到细胞膜中并形成孔道;( 4) 毒素在某些细胞因子的共同作用下,发生自我切割,产生易位作用,将毒素的GTD 释放到胞质内;( 5) GTD 发挥催化作用使Rho GTP 酶家族糖基化,GTP结合蛋白失活,靶细胞肌动蛋白细胞骨架解聚,细胞通透性增加,细胞内物质外流,产生炎症,最终导致细胞死亡、肠壁坏死、液体积蓄、出现水样腹泻,坏死的肠壁细胞和炎症细胞在肠黏膜上形成伪膜。
艰难梭菌感染的流行病学
近年来,CDI 已对全球性公共健康造成威胁[3],然而不同国家和地区报道差异较大。来自美国和欧洲的数据表明,CDI 的发病率偏高但正趋于稳定,其总体发病率已高于耐甲氧西林金黄色葡萄球菌引起的感染,成为医院相关性腹泻的首要病因[4]。美国疾病控制和预防中心( Centers for Disease Control and Prevention,CDC) 在2013 年发布的统计数据显示:美国每年CDI 患者超过25 万,其中至少1. 4 万人死于该种疾病[5]。加拿大CDI 发病率从1997 年的3. 8 /万住院日上升至2005 年的9. 5 /万住院日[6]。在亚洲,韩国的一项多中心研究发现,成人住院患者CDI 发病率从2004 年1. 7 /万住院日上升至2008 年的2. 7 /万住院日,低于同期美国成人住院患者发病率( 8. 75 /万住院日) [7]。2007 至2008 年上海一家医院的研究发现,其住院患者CDI 的发病率为17. 1 /万住院患者[8]。
2002 年以来,一种高产毒CD 在北美和欧洲暴发流行,其PCR-核糖体分型027 型/脉冲场凝胶电泳分型NAPl 型/限制性内切酶分型BI 型( 简称RT027 /NAP1 /BI) ,该型菌株引起的临床症状更加严重且传播性更强,易复发,预后差,导致CDI 发病率快速增加[9-10]。截至目前,该高产毒株已蔓延至美国48 个州和欧洲16 个国家,成为美国、比利时、北爱尔兰( 英国) 、苏格兰( 英国) 和西班牙等国家和地区的优势流行菌株。其他国家也相继发现此高产毒株,如澳大利亚、墨西哥、智利、希腊、捷克和波兰等国家均已分离到RT027 型[11]。近年来,亚洲也不断出现RT027 型菌株的报道,但均为散发病例[12]。中国的香港、台湾和大陆地区也相继报道发现了RT027 型菌株[13]。虽然很多国家已发现RT027 型高产毒株,但并非所有国家都以RT027 型为优势流行菌株。在中国,引起感染的CD 有其独特的流行病学特征,主要流行菌株为RT017 ( ST37) ,RT046 ( ST35) 和RT012( ST54) [4, 14]。而中国健康人分离的CD 则以多位点序列分型ST54、ST3 和ST2 为主[15]。
艰难梭菌感染的危险因素
长期暴露于广谱抗菌药物,尤其是克林霉素、氟喹诺酮类和第三代头孢菌素患者,具有严重基础疾病患者,老年人,使用免疫抑制剂或免疫低下、糖尿病、肾功能衰竭、胃肠手术、管饲、肠道准备、营养不良、炎症性肠病( 尤其是溃疡性结肠炎) 患者,以及长期使用质子泵抑制剂和抗组胺剂( 如H2受体阻滞剂) 等患者容易发生CDI[16],尤以胃肠手术后合并使用广谱抗菌药物的患者发生风险最高[17]。
艰难梭菌感染的临床表现
CDI 临床症状最早可出现在开始用药后数小时至2 d 之内,最晚可于停药后3 周内出现。症状可由单一腹泻到中、重度感染包括发热、腹痛、腹胀,腹泻初期为水样便,常多于3 次/24 h,后期可发展为脓血便。重症患者白细胞增多。严重感染表现为水样便伴有脱水、中毒性结肠炎和脓毒血症,粪便中可有黏膜状物存在。
艰难梭菌感染的诊断
CDI 诊断标准为:患者出现中至重度腹泻或肠梗阻,并满足以下任一条件:( 1) 粪便检测CD 毒素或产毒素CD 结果阳性; ( 2) 内镜下或组织病理检查显示伪膜性肠炎。
病原学检查
1. 粪便标本采集
一般情况下,仅需对稀便、水样便或半成形便进行CD 检测。对于疑似有CD 感染及肠梗阻的患者,应通过直肠拭子进行检测。在出现明显腹泻症状( ≥3次/24 h、持续超过2 d) 及进行针对性治疗前,采集不成形粪便标本( 推荐10 ~ 20 ml,不少于5 ml) 送检。CD 毒素室温下易降解,应于取材后2 h 内送检并立即检测; 如不能立即检测,则需将标本置于4 ℃冰箱保存,不超过3 d。
2. 艰难梭菌菌株检测
( 1) 培养
常采用CCFA 培养基( cefoxitin cycloserine fructose agar,CCFA) 或CD 显色培养基进行厌氧培养。CCFA 培养基需培养48 ~ 72 h,对粪便标本通过加热或乙醇预处理可以减少粪便正常菌群,筛选出细菌芽孢。CD 在CCFA 上具有典型的“马粪”气味,菌落在紫外光下显示黄绿色荧光,典型的菌落可使用API 20A、Vitek 2 Compact 或者MALDI-TOF MS 技术等进行鉴定[18]。
使用CD 显色培养基可以缩短培养时间至18 ~24 h,且无需对粪便样本进行加热或乙醇等预处理。CD在显色培养基上的菌落具有黑色、扁平、粗糙、边缘不整齐的特点,同时可以达到直接鉴定CD 的目的。
厌氧培养敏感度较高,但不能区分菌株是否产生毒素,可作为难辨梭菌筛查的有效方法之一,菌株可用于流行病学调查。
( 2) 谷氨酸脱氢酶检测
谷氨酸脱氢酶( glutamate dehydrogenase,GDH)是所有CD 高水平表达的代谢酶,可用于筛查疑似
CDI 患者粪便样本中是否存在CD。通常使用酶免疫方法( enzyme immunoassays,EIAs) 直接检测粪便标本中的GDH 抗原。检测时间约1 ~ 2 h,操作简便且成本较低。系统综述显示该试验具有较高的敏感度( > 90%) 、特异性( > 90%) 和阴性预测值( 95% ~100%) [17],但同CD 培养一样,不能区分菌株是否产生毒素,近20%的GDH 阳性患者的CD 不产生毒素。该方法可作为一种高度敏感的初筛试验,GDH 试验阴性,可直接报告临床用于排除CDI; GDH 试验阳性,需要进一步检测其毒素或毒素基因进行确证[19]。
3. 艰难梭菌毒素检测
( 1) 细胞毒性试验
细胞毒性试验( cell cytotoxicity assay,CCTA) ,即细胞毒性中和试验( cell cytotoxin neutralization assay,CCNA) ,用于直接检测粪便标本中存在的CD 毒素。将不成形稀便标本离心,上清经0. 45 μm 滤膜过滤,将无菌PBS 稀释的粪便滤液加入细胞悬液( Vero 或Hep2 细胞等) ,分别加入和不加入抗CD 毒素的中和抗体,37 ℃ 5% CO2环境培养,24 h、48 h 后显微镜
下观察细胞病变效应( cytopathiceffect,CPE) ,而加入特异性抗毒素抗体能阻止这种细胞病变[20]。CCTA 是实验室诊断CD 的金标准,特异性强,敏感度高( 最低可检测出10 pg 毒素) ,但需要细胞培养及显微镜观察的相应设施和技术,操作繁琐,耗时长( 48 ~72 h) ,判定结果需要一定经验的技术人员,不适宜临床常规检测[21]。
( 2) 产毒素培养
产毒素培养( toxigenic culture,TC) 用于检测CD菌株的产毒素能力。将不成形稀便标本接种于CCFA培养基或CD 显色培养基上,37 ℃厌氧培养至少48 h,挑取典型菌落接种至液体培养基中,厌氧培养48 h,0. 45 μm 滤膜过滤培养上清进行细胞毒性试验[20]。也可用EIAs 检测固体培养基上菌落产毒素能力,检测时间可缩短至2 ~ 3 d,但敏感度稍低[17]。TC 是实验室诊断CD 的参考方法,敏感度高,特异性强,但操作繁琐,耗时长( 5 d 左右) ,结果判读的技术人员需要有一定经验,不适宜临床常规检测,可用于流行病学监测,并作为评价其他检测方法的参考标准[22]。
( 3) 毒素免疫检测
目前常用EIAs 直接检测腹泻粪便标本中的CD 毒素,用单克隆抗体特异性结合CD A/B 毒素蛋白进行检测。EIAs 检测CD 毒素的优点是特异性高( > 90%) ,能区分产毒株和非产毒株,并且检测周期短,数小时即可出结果,操作简便,应用广泛; 缺点是敏感度较低( 39% ~ 76%) ,不能单独用于CD 感染的实验室诊断[2, 21, 23]。目前,EIAs 检测CD 毒素常和GDH 检测或核酸扩增技术( nucleic acid amplification tests,NAATs) 联合应用,用于CD 感染实验室两步法或三步法诊断[21]。
4. 艰难梭菌毒素基因检测
可采用实时PCR 或环介导等温扩增法( loop-mediated isothermal amplification,LAMP) 等分子生物学技术,定性检测粪便样本中的CD 毒素基因。商品化的检测系统包括GeneXpert ( Cepheid,美国) 、FilmArray( 梅里埃,法国) 等,此类方法将样品提取、纯化、核酸扩增、产物自动化检测整合,通常可在2 h 内完成检测。此外,GeneXpert 可以检测tcdC 基因的突变和缺失,预测高产毒菌株RT027 型CD。NAATs 具有高敏感度和特异性,该方法可作为唯一的独立测试技术检测产毒素CD[21, 24],且检测时间短,能够及时隔离和治疗CDI 患者,从而减少院内传播的机会,并改善患者预后。但NAATs 的应用受限于其检测成本较高,需要特殊检测设备。
表1 艰难梭菌感染不同诊断方法优缺点比较
检测方法 | 检测物质 | 耗时 | 费用 | 优点 | 缺点 |
培养 | 艰难梭菌 | 1~3d | + | 可获得菌株株 | 耗时长,不能区分非产毒 |
GDH | 艰难梭菌 | 1~2h | +++ | 简单、快速、 | 敏感度高不能区分非产毒株 |
CCTA | 毒素B | 1~3d | ++ | 金标准 | 耗时长,技术要求高 |
TC | 产毒素艰难梭菌 | 3~5d | ++ | 参考方法 | 耗时长,技术要求高 |
毒素EIAs | 毒素A/B | 1~2h | +++ | 简单、快速、特异性 | 高敏感度低 |
NAATs | 毒素基因 | 1~2h | ++++ | 快速、敏感度高、特异性高 | 成本高 |
GDH:谷氨酸脱氢酶; CCTA:细胞毒性试验; TC:产毒素培养; EIAs:酶免疫方法; NAATs:核酸扩增试验
5. 推荐实验室诊断流程
不同的诊断方法各有优缺点,见表1。综合考虑不同方法的敏感度、特异性、耗时、费用等因素,推荐使用两步法或三步法进行CDI 诊断。( 1) 三步法:即首先使用GDH 试验初筛,GDH 阳性进行毒素EIAs 试验,二者结果不一致使用CCTA、TC 或NAATs 确证( 图1) 。( 2) 两步法:即同步联合检测GDH 和毒素EIAs 试验,二者结果不一致使用CCTA、TC 或NAATs确证( 图2) 。
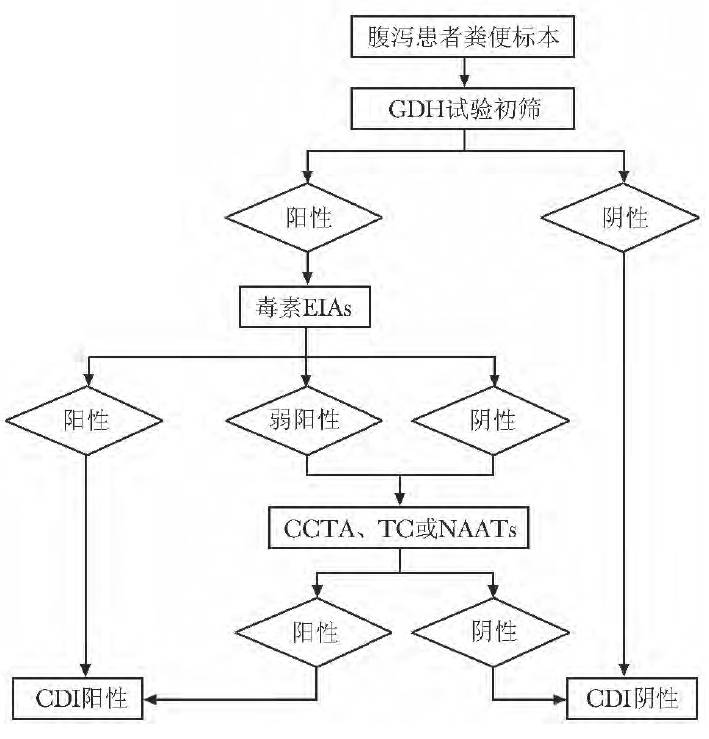
图1 艰难梭菌感染推荐实验室诊断流程,三步法GDH、CCTA、TC、EIAs、NAATs:同表1; CDI:艰难梭菌感染
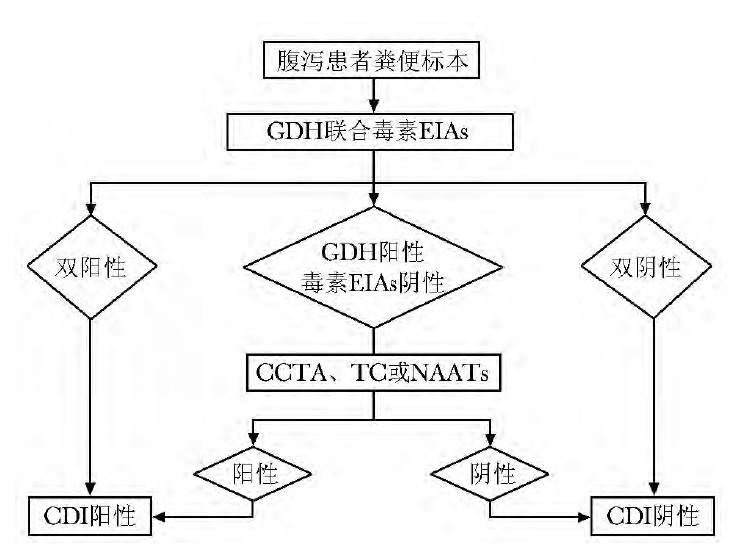
图2 艰难梭菌感染推荐实验室诊断流程,两步法GDH、CCTA、TC、EIAs、NAATs:同表1; CDI:同图1
其他相关实验室检查
轻至中度感染患者外周血白细胞可正常,严重感染者白细胞可达15 × 109 /L 以上。血清降钙素原( procalcitonin,PCT) 对诊断CDI 意义不大,但PCT> 0. 2 ng /ml时,提示CDI 有重症化趋势。合并脓毒血症时,相应脏器损害的功能指标也异常,如血肌酐超过正常值1. 5 倍,血清白蛋白< 2. 5 g /L。
CT 检查
CT 检查对于诊断CDI 缺乏特异性和敏感度。若发现结肠壁增厚、结节状结肠袋增厚、水肿厚度> 4 cm,特别是炎症部位在升结肠时,对于重症CDI感染患者有一定辅助诊断意义。暴发性CDI 常出现腹水、缆绳征等。
内镜检查
内镜检查为诊断CDI 的重要手段之一,尤其在病原学依据缺乏或难以与其他炎症性肠病相鉴别时。典型内镜下特征表现为伪膜性病变,主要征象包括黏膜充血、水肿、糜烂、溃疡、直肠乙状结肠有多发性隆起的斑片或融合为大片的灰绿色、黄褐色伪膜覆盖黏膜表面; 严重者病变融合; 伪膜邻近的黏膜可呈水肿、充血,触及易出血,也可见散在溃疡; 伪膜性病变主要累及左侧结肠或全结肠,少数累及回盲部。部分CDI 患者内镜下表现可不典型,尤其炎症性肠病合并CDI 时多无特征性伪膜性病变。内镜活检组织检查无特异性诊断价值,病理结果常提示为非特异性结肠炎。
艰难梭菌感染的治疗
CDI 治疗的首要原则是尽可能停止正在使用的抗菌药物; 其次,口服有效治疗药物。静脉注射甲硝唑的疗效未得到证实,静脉注射万古霉素无效; 此外,根据患者感染的严重程度,给予不同的治疗方案。国内尚无万古霉素口服制剂,可用注射用万古霉素或去甲万古霉素溶入生理盐水或葡萄糖溶液,口服或胃管入。
内科治疗
1. 治疗方案
( 1) 无症状CD 携带者:不存在腹泻、肠梗阻、结肠炎等临床症状的患者。不推荐进行CD 实验室检测及治疗。
( 2) 轻-中度感染:CDI 患者有腹泻等肠炎样症状,但没有重症感染表现。给予甲硝唑500 mg ( 口服或胃管入) ,每8 h 一次。
( 3) 重症感染:CDI 患者有腹泻,且存在以下任何一项因CDI 导致的异常:白细胞> 15 × 109 /L、血肌酐较基线升高> 50%、内镜发现伪膜。给予万古霉素125 mg 溶液( 口服或胃管入) ,每6 h一次。
( 4) 重症感染伴并发症:CDI 患者符合重症感染诊断标准,且存在以下至少一项因CDI 导致的异常:低血压、肠梗阻、中毒性巨结肠或弥漫性结肠炎、肠穿孔、需结肠切除、因CDI 入住重症监护病房治疗。首先需外科、感染内科医生会诊,评估结肠切除手术指征; 给予万古霉素500 mg,每6 h 一次,配伍甲硝唑500 mg ( 胃管入) ,每8 h 一次; 患者一旦病情稳定,万古霉素即应减量至125 mg,每6 h 一次,同时停用甲硝唑; 口服给药受限或完全性肠梗阻的患者,可经Foley 导管给予万古霉素500 mg ( 溶于100 ml生理盐水) 直肠保留灌肠每6 h 一次,配伍甲硝唑500 mg,静脉输注,每8 h 一次,该项治疗存在结肠穿孔的风险。
( 5) 复发性CDI:即使完成疗程的CDI 患者,仍有20%左右的复发可能[25],其原因并非对甲硝唑或万古霉素耐药,而是芽孢清除失败或感染了新的CD。第一次复发时仍可采用原治疗方案; 第二次复发时应给予万古霉素并逐渐减量,配合脉冲式给药模式或粪便菌群移植。万古霉素减量方法:125 mg,4 次/d,10 ~ 14 d; 125 mg,2 次/d,7 d; 125 mg,1 次/d,7 d; 125 mg,1 次/2 ~ 3 d,2 ~ 8 周[26-27]。
2. 注意事项
( 1) 疗程:10 ~ 14 d。
( 2) 以下情况可考虑万古霉素或去甲万古霉素溶液( 口服或胃管入) :服用甲硝唑治疗5 d 无效; 复发性CDI ( 第二次发作开始即可给予) ; 妊娠; ≥65 岁的患者; 存在其他甲硝唑治疗禁忌及显著不良反应。
( 3) 仍需使用广谱抗菌药物治疗其他部位感染的CDI 患者:尽可能替换在用的诱发CDI 的抗菌药物,特别是头孢菌素、克林霉素和喹诺酮类; 尽可能缩短疗程; 若调整药物后CDI 有所缓解,应给予CDI 标准疗程10 ~ 14 d; 若诱发CDI 的抗菌药物无法替代或停药,则抗CDI 药物需要延长到抗菌药物疗程结束1 周[28]。
( 4) 抗CDI 药物治疗不需要检测CD 以确定CDI是否治愈[21]。
( 5) 尽可能避免使用止泻剂。
( 6) 尽可能避免使用质子泵抑制剂,因可增加CDI 的患病风险。
( 7) 对接受抗菌药物治疗基础感染病而非CDI 的患者不需要给予甲硝唑或万古霉素进行CDI 的预防治疗,因可能增加CDI 的患病风险。
( 8) CDI 患者住院期间应进行接触隔离; 使用水、肥皂进行手卫生而不能使用含乙醇手消毒剂[21, 29]。
3. 内科治疗其他药物
( 1) 非达霉素:一种大环内酯类药物,抗菌谱窄,对肠道正常菌群影响小,疗效与万古霉素相当,
但复发率更低,有可能成为CDI 患者( 包括重症CDI) 口服治疗的一线药物[30-31]。
( 2) 利福昔明:常在治疗接近终点时给予,可减少多次复发的可能[32]。
( 3) 替加环素:虽然美国食品和药物管理局( Food and Drug Administration,FDA) 已批准的适应症不包括用于CDI 治疗,也缺乏随机对照研究证据,但有个案报道经过7 ~ 24 d 替加环素治疗,重症CDI 患者获得了痊愈[33]。
( 4) 静脉注射免疫球蛋白:有文献证实其治疗效果,但需要更多研究支持[34]。
外科治疗
1. 所有重症CDI 患者都应该进行腹部CT 检查,明确是否存在中毒性巨结肠或全结肠炎,以尽早确定外科干预的时机。
2. 若患者CDI 导致的临床情况不稳定,如肠穿孔、中毒性巨结肠、内科治疗无效、重症感染性休克等,即应尽早开始外科干预,如结肠切除。新方法包括结肠旷置回肠造瘘、保留结肠并万古霉素冲洗术等。
3. 结肠切除术的病死率高达25% ~ 75%。
4. 手术应在血清乳酸> 5 mmol /L 前实施。
5. 结肠次全切除术保留直肠的CDI 患者,术后仍需持续进行内科药物治疗。
其他治疗方法———粪便菌群移植
1. 适应症:仅适用于复发性CDI,尤其是第三次发作以后。治愈率可高达90%以上[35-36],但对于接受结肠次全切除术的患者,效果不确定。
2. 受者要求:操作前2 d 不接受任何抗菌药物治疗; 由于粪便菌群移植的有效性取决于治疗前结肠清洁状况,故建议操作前晚餐进流食、并接受灌肠或导泻剂清理肠道。
3. 粪便供者要求:过去6 个月内未使用过抗菌药物、免疫功能正常、无纹身、未吸食毒品、无高危性行为、未被监禁、近期无疫区旅游史、无慢性消化道疾病如炎症性肠病。
4. 粪便供者筛查:血液检查包括乙型肝炎病毒、丙型肝炎病毒、艾滋病病毒及梅毒; 粪便检查
包括虫卵和寄生虫、CD、粪便培养和药敏、鞭毛虫抗原。
5. 供者粪便收集:供者操作前晚上服用导泻药,第二天早上收集粪便, 混入500 ml 盐水; 尽
可能混匀粪便; 可以使用咖啡滤纸过滤粪渣制成悬液; 悬液保存在低温容器中运送,并在6 h 内完成移植。
6. 途径和方法:多数经结肠镜进行粪菌移植,少数情况使用鼻胃管进行操作。受者到达操作间时服用盐酸洛哌丁胺胶囊( 易蒙停) 2 片,以缓解肠蠕动;准备好的500 ml 粪菌悬液经结肠镜注入患者右半结肠; 嘱受者尽可能避免排便,保留至少2 h。
结语
在医学发展史上,有关CD 的描述可上溯至1935年。随着人类抗菌药物的广泛应用,以及CD 高产毒株RT027 型的出现及传播,CD 给人类带来的危害在近20 余年中日益凸显。然而,与世界发达国家或地区相比,我国对CDI 的认识十分匮乏,表现在临床认知不充分,实验室检测能力不全面,同时缺乏有效的流行病学监测与科学研究。本共识对全球范围内该领域的进展进行回顾与综述,结合我国实际国情,期望为国内CDI 的诊断、治疗、感染控制等方面指明方向,提高业界整体水平与能力,有效应对CDI 给医学领域带来的挑